時期・組織特異的な遺伝子発現誘導を可能にするメダカ(Oryzias latipes)系統の開発
小林 佳代1・中村 修平1・田中 実1,2,3
基礎生物学研究所 生殖遺伝学研究室1 准教授2 総合研究大学院大学 基礎生物学専攻3
メダカは、日本でモデル生物としての地位が確立された生き物です。メダカは、飼育が容易で安価に動物を維持できること、卵が透明で初期発生の研究に適していること、近交系が確立されていること、全ゲノム配列の解読が完了していることなど、研究に使用する上で多くの利点があり、これらを組み合わせることで、他の動物では解析の難しいさまざまな生物現象を解明できると期待されています。
しかし、マウスとは異なり、遺伝子を任意に操作する技術がまだ確立されていないために、マウスのように遺伝子機能を破壊した「ノックアウトメダカ」を作製することは困難です。そこでメダカでは、遺伝子を直接操作する代わりにモルフォリノアンチセンスオリゴ*1を用いて、遺伝子機能を抑制する方法(ノックダウン法)が利用されてきました。けれども、この方法も発生初期にしか使えず、しかもすべての細胞に作用するため、発生後期や成魚における特定細胞での解析には使えません。生理学・内分泌学・再生の問題など、発生後期以降には多彩な生物現象があるにも関わらず、そこでの遺伝子機能や機構解明はほとんど手つかずの状態で残っています。そこで私たちは、発生後期や成魚でも遺伝子機能が操作できるように、熱誘導系とcre/loxP系*2を組み合わせて、異なる時期や組織でも遺伝子発現を誘導できるメダカトランスジェニク系統(hsp-cre、gapdhp-loxP)の作製を試みました。
*1 RNAに似て4種の塩基をもつが、骨格部分の化学構造がことなる物質。細胞内に注入すると、相補的な配列をもつmRNAに結合して翻訳を阻害する。生物学辞典(東京化学同人)より)
*2 cre-loxP系:creは組換え酵素(リコンビナーゼ)であり、特定のDNA配列(loxP)を認識して組換えを起こします。 loxPが同じ方向に2つ存在する時、creはloxPに挟まれた領域を切り出すことができます。この性質を利用し、creやloxPの制御領域を工夫することによって遺伝子の発現を操作することができます。
|
 メダカトランスジェニック系統(cre/loxP)の開発 |
図1に今回使ったcre/loxP系の概略図を示します。生体内の遺伝子機能を調べるためには、遺伝子の発現する場所と働き出すタイミング(時期)の2つが制御できなくてはなりません。特定の組織に発現させるための仕掛けとして、ある組織Aで働く制御領域Aを、DsRed遺伝子の前におくことにします。これによって組織A でDsRed遺伝子の発現が活性化し、その組織が赤色蛍光を発するようになります。次に時期を制御する手だてとして、creリコンビナーゼの発現を任意の時期に誘導できるようにします。
この2つを組み合わせることで、creリコンビナーゼがある時期に働けば、2つのloxPに挟まれたDsRed遺伝子を含んだ領域がその時期に切り出され、DsRed遺伝子の後ろにおかれたEGFP遺伝子の発現が、新たに開始することが期待されます。この新たな発現は、EGFP遺伝子産物由来の緑色蛍光で判別がつきます。
|
| 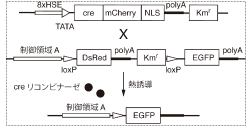
図1:cre/loxPの概略図
creリコンビナーゼのない状態では、制御領域AによってDsRedの発現が活性化されている。熱誘導後にcre リコンビナーゼによってloxPに挟まれた配列が切り出されると、EGFPの発現が開始される。 |
ここでEGFP遺伝子を、研究者が調べたいと思う遺伝子Xに置き換え、発現させたいと思う制御領域を、AからBへ変えることで、組織Bにおいて好きなときに遺伝子Xを発現させることが可能となり、その機能を調べることができます。
creリコンビナーゼを異なる時期に発現させるためには、cre遺伝子の制御領域にheat shock elements (HSEs) を導入し、熱をメダカにかけることで発現の時期を制御できるようなメダカを作製しました(hsp-cre系統)。今回は、作製したhsp-cre系統のcre遺伝子がどの組織でも機能するのかを確認するため、多くの組織で発現していると予想された遺伝子、gapdhの制御領域を loxP系統の制御領域として採用しました(gapdhp-loxP 系統)。 |
|
2種類のメダカ系統(hsp-cre、gapdhp-loxP)を独立に作製して交配し、creとloxPの両方を持ったメダカを得て熱誘導の効果を検討しました。
Stage 32-33の胚(体節形成期)を39℃で2時間熱処理し室温で7日間静置した後、EGFP発現の有無を観察しました。心臓・肝臓・鰭・腸・筋肉・前腎の一部の細胞でEGFPの誘導が確認できました(図2)。このことから、これらの組織ではhsp-cre系統を用いて任意の遺伝子を熱誘導する実験が可能と考えられました。 |
| 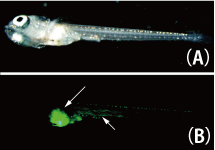
図2:メダカ胚において誘導されたEGFP
(A)明視野 、(B)筋肉、内臓部分(矢印)に誘導されたEGFPが見られる。 |
続いて成魚での熱誘導実験を行いました。これには2種類の方法(温浴、温冷負荷プローブ)を用いました。温浴は簡単に熱誘導を行うことができるためよく利用される方法ですが、全身でHSEsが活性化される可能性があります。温浴による熱誘導では、成魚を入れた水槽の温度を30度から39度まで30分に3度ずつ上昇させ、39度で2時間の熱処理を行いました。その後室温で14-16日間飼育し調べたところ、卵巣の一部の細胞でEGFPの誘導が確認できました。 |
一方、温冷負荷プローブ(BTC-201、ユニークメディカル)を用いた場合は、細長いプローブ(長さ50mm、径1.5mm)の先端をメダカの腹腔内に挿入することで局所的な熱誘導が可能です(図3)。私たちは40-42度で10分の熱処理を行い、室温で14-16日間飼育後に観察を行いました。その結果、卵巣においてプローブを当てた周辺でのみEGFPの誘導を確認しました。この方法を用いれば、非侵襲的に、小さい領域での熱誘導が可能であると期待されました。 |
| 
図3:成魚における、プローブによる熱誘導
メダカ腹腔内にプローブの先端を挿入して熱誘導を行う。 |
成体の脊椎動物卵巣では、卵を作り続けることのできる生殖幹細胞が存在するか、その存在を検定する手段がなく、長い間大きな問題として残されてきました。以前、メダカの卵巣においてnanos2遺伝子が卵原細胞で発現していることを当研究室の青木ら1)が見いだしていました。そこで中村らは私たちが開発したメダカを応用し、loxP系統の制御領域としてnanos2遺伝子発現制御領域を用い、hsp-cre系統のメダカと交配してnanos2遺伝子発現細胞の子孫細胞を追跡することを試みました(図4)。 |
| まず熱処理を行うことでloxPで挟まれた配列が切り落とされ、nanos2遺伝子発現細胞で緑の蛍光が観察されました。さらにこの緑の蛍光を追跡したところ、それらから3ヶ月の間、継続的に緑色蛍光をもつ卵が形成されていることが判り、卵巣中のnanos2発現細胞の中に生殖幹細胞が含まれていることを脊椎動物で初めて示すことに成功しました2)。
このように、私たちの作製したメダカ系統は、これまで技術的に困難であるが故に不明であった発生後期や成体での遺伝子機能や生物現象の解明を可能にすると考えられます。
文献
1) Aoki et al., 2009.Zool. Sci 26:112-118.
2) Nakamura et al., 2010. Science 328:1561-1563.
|
|
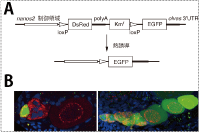
図4:nanos2発現細胞のクローン解析
(A)クローン解析の概略図
(B)(左)誘導直後はnanos2発現細胞でのみEGFPが見られるが、(右)時間が経つと全ての生殖細胞でEGFPが見られるようになる。 |
 謝辞 HSEsベクターはCzerny先生に、cre と loxP のベクターは生理研の東島先生に、Fosmid はNBRP medakaより供与していただきました。 |